Что такое аккумулятор? Каково его назначение? Для каких целей используются современные модели? Обзор посвящен ключевым вопросам, связанным с устройством, принципом действия современных аккумуляторов.
Назначение современных аккумуляторов
Аккумулятор – специально разработанное устройство, где выработка энергии происходит благодаря химическим процессам. Энергия, выделяемая при химических реакциях, преобразовывается в электрическую, далее отдает заряд для различных приборов, устройств. Процесс этот обратимый. При разряде батареи электрическая энергия переходит в химическую, накапливая при этом энергетический запас.
Аккумуляторные батареи могут работать в трех режимах:
- в циклическом, когда устройство работает автономно, без подключения к источнику питания;
- в буферном режиме, когда аккумулятор постоянно подключен к источнику тока;
- в смешанном, где происходит комбинация параметров первых двух режимов.
Для чего нужен аккумулятор? Аккумуляторная батарея – востребованный на сегодня источник энергии. Она создает необходимый запас электричества, чтобы питать различные электротехнические устройства, механизмы. Используются батареи тогда, когда нет возможности подключиться к централизованной электрической сети
Аккумуляторы в действии: как работает аккумуляторная батарея?
Аккумуляторные батареи, как и любая другая техника, имеют свое оригинальное устройство, структуру. В современных аккумуляторах используются определенные материалы, внедряются системы, основанные на физических и химических свойствах конкретных веществ и металлов. Рассмотрим принцип работы аккумуляторной батареи на примере свинцово-кислотных.
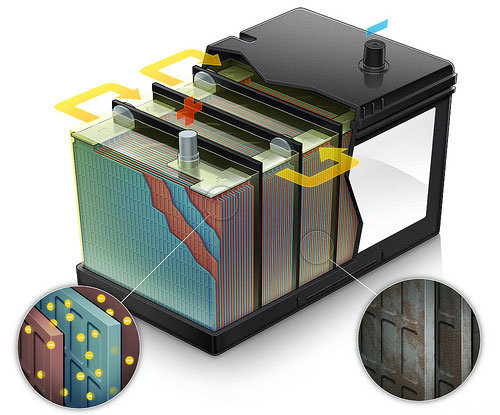
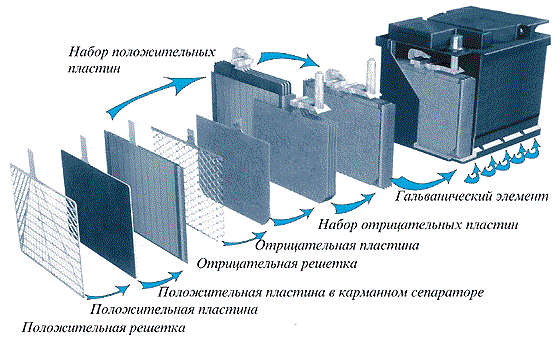
Первое, с чем мы сталкиваемся – корпус. Корпус батареи должен быть надежным, качественным. Ведь внутри, забегая наперед, - сложные химические вещества. Ненадежный, хлипкий, некачественный корпус был бы попросту небезопасным для использования. Корпусная коробка, где помещены все основные элементы, обязательно должна быть стойкой к вибрациям, полностью герметизированной, на нее не должны оказывать химическое воздействие различные вещества, реагенты.
Под крышкой корпуса расположены два электрода – специальные пластины разных зарядов, положительного и отрицательного (в физической терминологии они называются анодом и катодом соответственно). Они зачастую изготавливаются из свинца, а сама конструкция таких пластин – решетчатая. Конструкция нужна для того, чтобы
химические реакции протекали более надежно и работоспособно.
Положительную пластину дополнительно намазывают так называемой активной массой – комбинация свинца и кислорода, в результате чего получается двуокись свинца (PbO2). Отрицательная электродная решетка покрывается активной массой из обычного губчатого свинца. В таблице Менделеева элемент обозначен как Pb.
Между электродными пластинами обязательно помещают дополнительный изоляционный материал. Делается это для того, чтобы при использовании батареи избежать короткого замыкания.
Последний элемент нашей батареи – электролит, который представляет собой жидкость серной кислоты. В жидкость помещаются электродные решетчатые блоки.
Принцип работы аккумулятора не сложен, однако нужно понять все, что происходит внутри:
- когда к аккумулятору подключается нагрузка (какой-нибудь электронный прибор, механизм и проч.), внутри батареи образуется замкнутая цепь из комбинации электродных пластин, электролита и непосредственно нагрузки;
- внутри аккумуляторной батареи начинается происходить ожидаемая нами реакция: активный массы двух пластин (Pb и PbO2) начинаются преобразовываться в совсем другое вещество – сернокислотный свинец (формула его выглядит так – PbSO4);
- плотность электролитного вещества (серной кислоты) начинает постепенно снижаться;
- в замкнутой цепи начинают двигаться ионы, после чего начинает течь электрический ток.
Описанный выше процесс называется разрядом – когда аккумулятор в результате внутренних химических преобразований отдает электрический ток. Обратный процесс – заряд, когда к батарее подключают внешний источник тока. При обратном процессе все вещества восстанавливаются, электролитная масса (серная кислота) начинает обретать свою первоначальную плотность.
История аккумуляторов
 |
Первый аккумулятор по официальным данным изобрел в 1798 году Алессандро Вольт – итальянский ученый, разработавший первый химический источник тока. |
 |
1802 – физик Круикшэнк из Англии изобретает батарею, которую начали выпускать в промышленных масштабах. |
 |
С 1820 ряд мировых ученых (Ампер, Фарадей, Дэниэл и другие) разрабатывал новые концепции, физические и химические законы, связанные с аккумуляторами. |
 |
1899 – Вальдмар Юнгнер разрабатывает батарею, где электродами выступали пластины из кадмия и никеля. |
 |
1901 – известный ученый Томас Эдисон изобретает бюджетную по стоимости модель железно-никелевого аккумулятора. |
 |
1947 – благодаря ученому Нойману батарея стала полностью герметичной. |
 |
1970-е – разработаны первые модели популярных свинцово-кислотных аккумуляторов. |
 |
В 1990-х начинается разработка и производство новых моделей аккумуляторов на основе металлгидрида и никеля. |